Сообщество пациентов следило за развитием Понатиниба с первых представленных данных первого этапа испытаний препарата на ASH в 2009 году, называемого под рабочем именем AP24534, а сегодня Понатиниб/ Иклусиг. Понатиниб заслужил много внимания как единственный препарат эффективный против мутации T315i и других мульти-резистентных мутаций, а также как хороший вариант лечения для многих пациентов у которых терапия Иматинибом, Дазатинибом и Нилотинибом оказалась нерезультативной. На основании принятых строгих нормативных регуляторов относительно побочных эффектов, ХМЛ-сообществу было интересно узнать новые данные о Понатинибе на ASH в 2014 году. Особый интерес вызвала изменённая информация о побочных эффектах и факторах риска, и то, что участники исследования, которые были вынужденные сократить дозу Понатиниба, всё еще получают хороший ответ на терапию, но уже с лучшей переносимостью.
Предыстория
В декабре 2012 года, Понатиниб (Иклусиг) утверждается в США как единственный препарат эффективный при ХМЛ с мульти-резистентной мутацией T315I. Управление по контролю качества пищевых продуктов и лекарственных препаратов (FDA) 31 октября 2013 предложила производителю Понатиниба, фирме ARIAD, добровольно приостановить продажу Понатиниба и проведение всех клинических испытаний. Данное требование основывалось на наблюдении устойчивого роста числа случаев, которые были опасными для жизни - образование тромбов и тяжелая степень сужении кровеносных сосудов, при мониторинге соблюдения мер безопасности на текущих клинических испытаниях.
С января 2014 года, после дополнительной оценки данных, продажа Понатиниба возобновилась в США, но с более ограниченными утверждениями, обновленной информации по безопасности для врачей, и требованиями, чтобы ARIAD провело новые исследования базирующие на оценивании низких доз Понатиниба, ответа на лечение и его токсичности.
Параллельно с этим, Европейское Агентство по лекарственным средствам (EMA) Комитета фармакологической оценки риска (PRAC) провело обзор имеющихся данных и пришло к выводу, что риск закупорки кровеносных сосудов на Понатинибе скорее всего связан с дозой, однако доказательств было недостаточно, чтобы официально рекомендовать использовать более низкие дозы, которые, с другой стороны, не могут быть столь же эффективным как для всех пациентов так и при длительном лечении. В отличии от FDA, но потенциально по той же причине, Европейское Агентство по лекарственным средствам (EMA) позволило использовать Понатиниб только в качестве препарата третьей линии после неэффективности терапии Дазатинибом, Нилотинибом.
Утвержденная доза Понатиниба в Европе продолжает оставаться - 45мг/сут, однако также требуется проведение дополнительных клинических испытаний.
Новые данные о Понатинибе, представленные на ASH 2014.
Подготовлено 6 презентаций и плакатов о Понатинибе на ASH конгресс в этом году.

На первой презентации – PACE-landmark, доктора Мартина Мюллера из Менгейма, предоставлены обновленные данные о ІІ-м этапе исследования PACE, анализируются полученные ответы на ХМЛ-препараты на раннем временном промежутке. Следует отметить, что в исследование включались пациенты, у которых терапия Дазатинибом, Нилотинибом оказалась неэффективной или развилась мутация T315I. 60% пациентов пробовали терапию, по крайней мере, трема препаратами ИТК до Понатиниба. 80% пациентов имели резистентность к Нилотинибу или Дазатинибу, и только у 15% была непереносимость к обоим препаратам. Среднее время с момента постановки диагноза - 7 лет, и средний период наблюдения за пациентами в этом исследовании - 38 месяцев. После 12 месяцев терапии Понатинибом, 56% пациентов достигли полного цитогенетического ответа и 39% большого молекулярного ответа (BCR-ABL <0,1%).
Двухлетняя выживаемость составила 90% из тех, кто достиг BCR-ABL <1% в течение 3 месяцев после начала приема Понатиниб, и 84% тех, у кого BCR-ABL был еще выше 1% после 3 месяцев терапии. Достижение большого молекулярный ответ (MMR) в начале лечения Понатинибом, даже для тех, у кого были проблемы с предыдущей терапией ИТК, прогнозировано улучшает исход. Это значит, что даже после неудачи лечения терапией 2-го поколения ИТК, значительная часть пациентов достигает хороших ответов на Понатинибе. Заблаговременный мониторинг ответа на лечение Понатимибом может решить вопрос о продолжении терапии Понатинибом либо перехода к трансплантации костного мозга, исходя из наиболее предпочтительного варианта для конкретного пациента. Преимущества и риски при лечении Понатинибом, с учетом сопутствующих заболеваний должны быть оценены в контексте для каждого конкретного пациента.

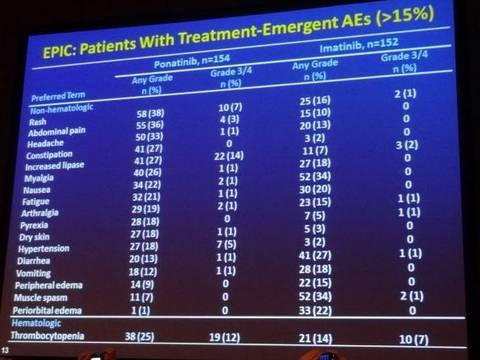
На второй презентации докторра Джеффа Липтон - EPIC-Vascular2A, описано исследование III этапа EPIC, в котором Понатиниб применялся в качестве терапии первой линии непосредственно сразу после постановки диагноза ХМЛ, и сравнено это с терапией Иматинибом. Несмотря на приостановление исследования в октябре 2013 из-за вышеупомянутых регулирующих мер безопасности, данные в отрезке времени, когда соблюдалась безопасность и эффективность - это в среднем 5 месяцев приема Понатиниба, сейчас представлены. Пришлось уменьшить дозу Понатиниба у 36% пациентов (первоначальной доза была 45мг/сут) из-за побочных эффектов и 57% пришлось прервать лечение. Однако 94% пациентов принимающих Понатиниб, в сравнении с 68% пациентов получавших Иматиниб, достигли BCR-ABL <10% за 3 месяца, и 15% пациентов на терапии Понатинибом, в отличие от ни одного на Иматинибе, достигли даже MR4.5 за такой короткий промежуток времени. Но на терапии Понатинибом чаще наблюдались случаи появления тяжелых побочных эффектов. Наиболее основными стали серьезные случаи образования тромбов, которые наблюдалось у 7 % на терапии Понатинаба, и лишь у 1% на Иматинибе. Однако, из этих12-ти пациентов, у которых развилось сужение кровеносных сосудов, 11 имели по крайней мере один фактор риска появления сердечно-сосудистых заболеваний или подобные ситуации в прошлом.
Так может доза в 45 мг/сутки в качестве начальной дозы во всех испытаниях была завышенной? Фиксированная стартовая доза 45 мг/сутки использовалась во всех последних исследованиях Понатиниба, но возможность и прерывания лечения и снижение дозы в этих испытаниях, в сочетании с многократным исследованием молекулярного ответа у больных, позволило определить зависимость доза-ответ.
Анализ, представленный на постере #4546, демонстрирует, что среднее число дней, требуемое для снижения начального уровня BCR-ABL в 10 раз - 47.5 дней для Понатиниба, тогда как для Иматиниба это число двое больше. Для ново-диагностированных пациентов, даже доза 15 мг Понатиниба в день, вызывает более быстрое уменьшение уровня BCR-ABL, чем 400 мг/сутки Иматиниба.
Что касается взаимосвязи дозы и побочных эффектов, анализ 671 пациента из различных исследований, представленный на постере #4546, показал, что уровень дозы Понатиниба связан с множеством побочных эффектов, включая свертывания крови и сужение сосудов.
Проведённые исследования подтверждают правильность метода снижения среднего уровня дозы. Например, начинать терапию с более низкой дозы и/или снизить дозу при достижения ответа на лечения, чтобы уменьшить токсичность, и при этом, продолжить высокоэффективное лечение. Ныне идет подготовка к испытаниям по варьировании дозы Понатиниба для оценки пользы/риска различных схем дозирования препарата.
Размышления
Большая часть информации, представленная на ASH 2014, отражает важность и эффективность Понатиниба, даже в качестве третьей линии терапии. Однако также были подчеркнуты проблемы токсичности Понатиниба, которые оказались более сильными для недавно утвержденной дозы 45 мг в сутки, чем на любые другие ИТК-препараты в стандартной дозе. Понатиниб является достаточно важным для лечения пациентов с мутацией T315, резистентностью или непереносимостью Иматиниба, Дизатиниба и Нилотиниба, и может быть даже единственным вариантом.
Производится впечатления, что испытания проводились на завышенных требованиях к дозированию и фокусировались на получения эффективного результата, в то время как токсичность достаточно хорошо не исследовалась. Это привело к неудачно регулированным «американским горкам» для пациентов, органов власти и производителей, когда выяснилось, что значительная часть пациентов страдает от серьезных побочных эффектов. Механизмы, которые вызывают эти побочные эффекты все еще плохо изучены (не только в случае Понатиниба, но также для редких, но существующих случаев сердечно-сосудистых заболеваний у некоторых пациентов на терапии Нилотинибом, Дазатинибом и Иматинибом). Тезисы, прозвучавшие на ASH 2014, демонстрируют - сообщество проводит много исследований на эту тему и продолжает изучать препараты ИТК, что опять же является одним из преимуществ для пациентов, которые участвуют в испытаниях в сравнении с теми, кто принимает новые препараты дома, так как большинство испытаний и клинических исследований включают в себя постоянный сердечно-сосудистый мониторинг пациентов из групп риска.
На ASH 2014, стало очевидным, что врачи в дальнейшем будут наблюдать более внимательно за сердечно-сосудистыми факторами риска у каждого из пациентов, особенно, с высоким кровяным давлением, диабетом и у тех, у кого уже происходили случаи сердечно-сосудистых заболеваний. Информация о Понатинибе, представленная на ASH 2014, очень хорошо отражает дискуссию по поводу всех преимуществ и рисков терапии препаратом. Это обеспечивает хорошую основу для исследования диапазона доз с изучением динамических схем дозирования для эффективного лечения со снижением побочных эффектов.
Например, предстоящие испытание SPIRIT3 в Великобритании, скоординированное доктором Стивеном О'Брайен, будет рассчитывать оптимальную дозу Понатиниба для пациентов, которые не получают оптимальный ответ на препараты первой линии ИТК, а также будет использоваться шкала QRISK2 для оценки риска сердечно-сосудистых заболеваний. Акцент будет сделан на нахождении правильного баланса между эффективностью и риском для каждого конкретного пациента.
Такое инновационное испытание как SPIRIT3, а также пациенты, которые решили присоединиться к клиническим исследованиям, несомненно, помогут обществу понять все вышеупомянутые вопросы гораздо лучше в будущем.
Giora Sharf & Jan Geissler, 13 декабря 2014
Адаптивный перевод, Галины Теслюк
Оригинал: http://www.cmladvocates.net/3-news/newsflash/423-ash-2014-new-data-on-ponatinib-most-potent-but-overdosed
Обсуждение на форуме http://osanna.com.ua/forum/viewtopic.php?f=5&t=125&p=1363#p1363