

Образовательная сессия ежегодного собрания Американского Общества Гематологов (ASH) в этом году проходила под девизом «Пересмотр состояния терапии Хронического Миелоидного Лейкоза». Образовательные сессии по ХМЛ посвящены обычно широкому обзору последних достижений в понимании болезни, тому, как эти достижения способствуют предотвращению прогрессирования заболевания и развитию лекарственной резистентости в клинических условиях, а также посвящены стратегии исследования долгосрочного контроля болезни и излечению.
В прежние годы образовательные сессии по ХМЛ были сфокусированы на видах лечения, направленных на повышение выживаемости, нынешняя образовательная сессия продемонстрировала, что ХМЛ медленно движется в направлении эры, когда выживаемость пациентов с ХМЛ будет близка к таковой у населения в целом. Сегодняшние усилия сосредоточены на ремиссии без лечения и качестве жизни. Излечение для всех было бы, конечно же, следующим шагом, однако излечение все еще где-то далеко за горизонтом для большинства пациентов, хотя многое сейчас исследуется в этом направлении.
Какой ингибитор тирозинкиназы выбрать? Профессор Тим Хьюз (Dr Tim Hughes)
Профессор Хьюз из Австралии открыл образовательную программу конференции ASH 2013 с обсуждения трех главных целей терапии ХМЛ в настоящее время:
- достижение нормальной продолжительности жизни (без прогрессирования ХМЛ и ущерба, вызванного лечением);
- обеспечение нормального качества жизни (сведение к минимуму токсичности лекарственного препарата);
- достижение ремиссии, свободной от лечения (опираясь на длительный и глубокий молекулярный ответ и подавления болезни за счет иммунитета).
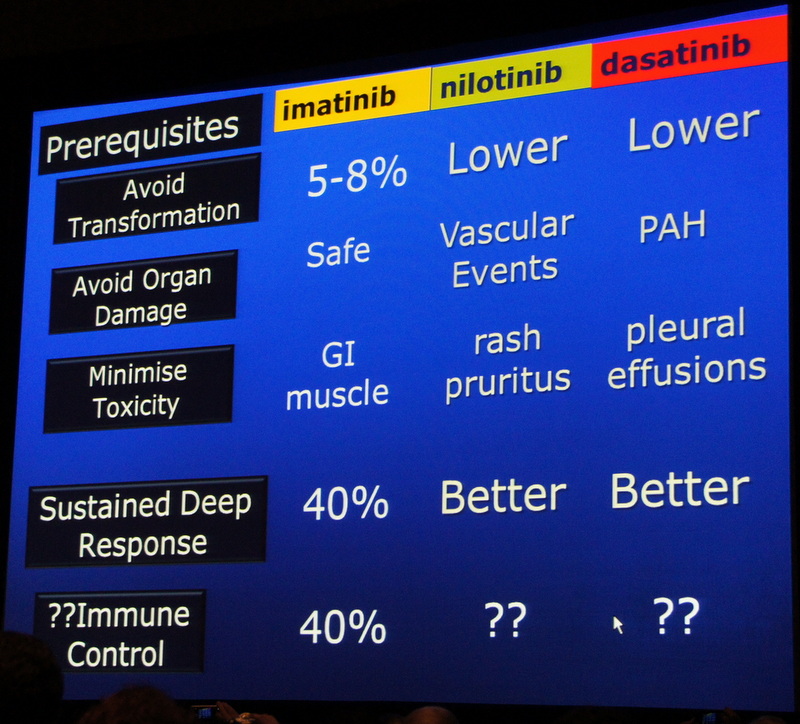
Относительно первой цели, доктор Хьюз отметил эффективность и безопасность препаратов первой линии терапии, доступной пациентам во многих странах мира сегодня. В сравнении с Иматинибом все три одобренных препарата второго поколения терапии ХМЛ: Нилотиниб, Дазатиниб и Бозутиниб – продемонстрировали более быстрые и глубокие ответы, а также значительно более низкий риск прогрессирования болезни. В то же время Иматиниб показал самый безопасный профиль токсичности. 30% пациентов, принимающих Нилотиниб, испытывали проблемы сердечно-сосудистого характера, причем большинство пациентов имели т.н. предшествующие факторы риска. На Дазатинибе наблюдалась тенденция увеличения количества пациентов с плевральным выпотом, четко связаная с возрастом (7% пациентов в год, и еще + 5% в следующие 2-4 года). На Иматинибе около 40% пациентов достигают глубокого молекулярного ответа, тогда как на Нилотинибе и Дазатинибе эти показатели оцениваются в 60-80%. Глубокий молекулярный ответ является необходимым условием для безопасного прекращения терапии, который отмечен у 40% пациентов.
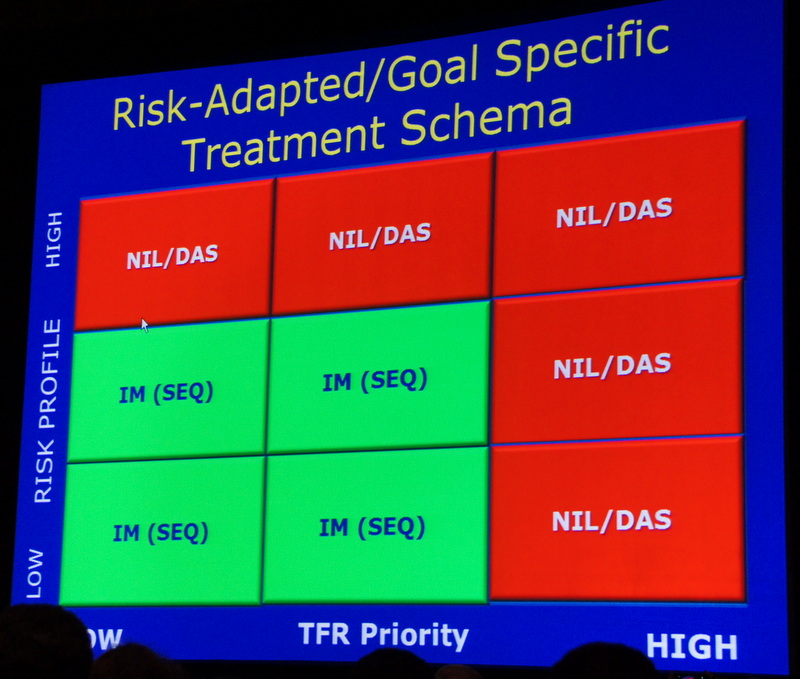
В качестве рекомендации для вновь диагностированных пациентов профессор Хьюз в общих чертах обрисовал отработанный подход: на момент установления диагноза пациенты должны быть оценены с учетом наличия одного или нескольких дополнительных заболеваний, с учетом индивидуального профиля риска прогрессии ХМЛ (низкого, среднего или высокого) и приоритета в возможности достижения ремиссии, свободной от терапии (низкий, средний и высокий уровни).
Пациенты с высоким биологическим риском и высоким приоритетом для прекращения терапии в глубокой ремиссии должны начать лечение с препаратов второго поколения ИТК. Все остальные могут начать лечение с Иматиниба и иметь потенциальную возможность перехода на второе поколение лекарственных препаратов в случае субоптимального ответа на терапию. Выбор препарата и мониторинг успешности терапии должен также учитывать и другие заболевания, такие как плевральные и сердечно-сосудистые.
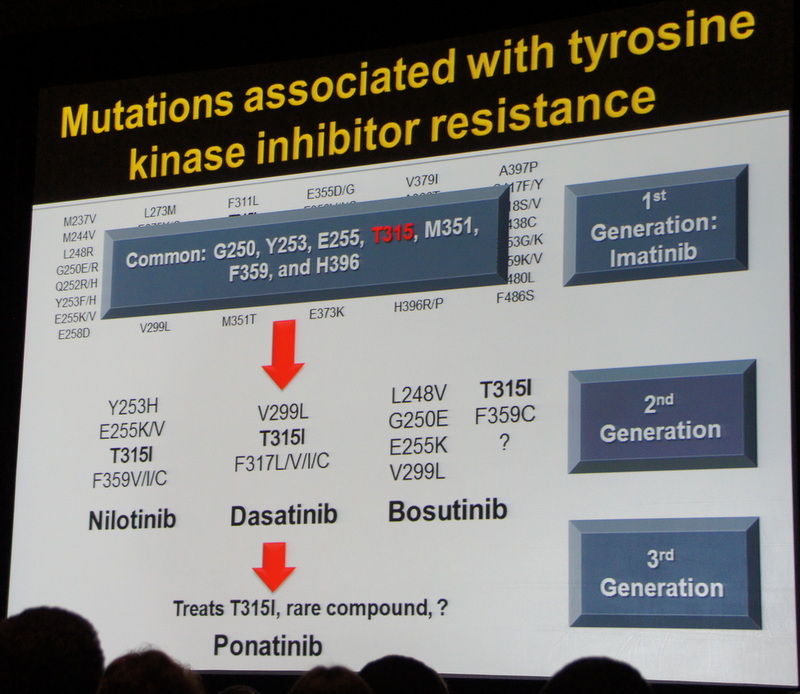
Мутационный анализ рассматривается как важнейший фактор в случае выбора ИТК второго поколения после неудачи предыдущей терапии. Понатиниб также показал высокую эффективность, однако его применение связано с высоким риском сердечно-сосудистых осложнений для пациентов с высоким риском развития гипертонии и повышенным уровнем липидов. Для таких пациентов специалисты рекомендуют снижение дозировки до минимума.
Обновления текущих рекомендаций по мониторингу: практические советы для клинической практики . Профессор Вивьен Оэлер (Dr. Vivian Oehler)
Доктор Вивьен Оэлер из Сиэттла, США, ознакомила аудиторию с существующими цитогенетическими и молекулярными методиками, используемыми в мониторинге ХМЛ, которые применяются в течение первых нескольких лет лечения, когда главная цель – предотвращение прогрессирования и лекарственной резистентности. В соответствии с текущими рекомендациями Европейской Лейкемической Ассоциации и NCCN, важные этапы лечения одинаковы при применении ИТК 2-го или 1-го поколения терапии ХМЛ, однако ранний молекулярный ответ ниже 10% BCR-ABL будет обеспечивать большую выживаемость без прогрессии (на 10-15%), тогда как худший ранний ответ может быть признаком более сложного течения заболевания у конкретного пациента или отсутствия приверженности терапии. При условии достижения большого молекулярного ответа к 12 или 18 месяцам, вероятность потери ответа на лечение в дальнейшем крайне низка.
Достижение глубокого молекулярного ответа имеет дополнительное преимущество в случае планируемой в дальнейшем отмены терапии. Однако важно, что прекращение приема препаратов должно проводиться только в рамках исследовательских программ.
Доктор Оэлер советует проводить исследования на мутации, если BCR-ABL все еще выше 10% к 3-м месяцам терапии, если нет полного цитогенетического или большого молекулярного ответа к 12/18 месяцам, если обнаруживается потеря большого молекулярного ответа или повышение на один логарифм уровня BCR-ABL, а также в случае, когда потерян гематологический или цитогенетический ответы или планируется переход на другой ИТК.
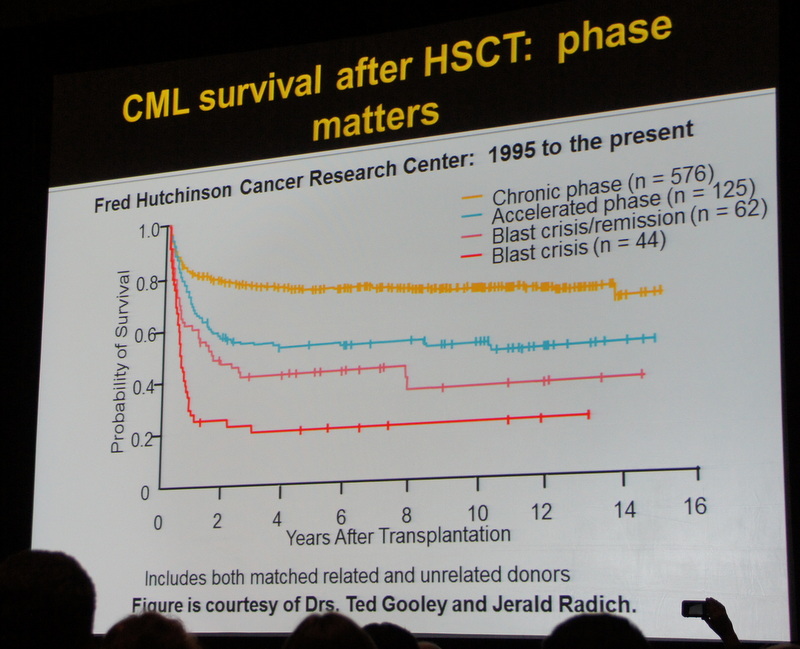
Когда необходимо выбирать следующую линию препаратов, тесты на мутации помогают определиться с дальнейшей тактикой лечения, так как некоторые мутации устойчивы к Нилотинибу, другие к Дазатинибу или Бозутинибу. В случае мутации T315I Понатиниб будет единственным препаратом выбора. Тем не менее, доктор Оэлер вновь подчеркнула, что ранняя пересадка стволовых клеток может быть рассмотрена как жизнеспособный вариант терапии прежде, чем перейти к 3-й линии ИТК. Согласно данным Центра Исследований Рака Фреда Хатчинсона, основанным на 800 проведенных трансплантаций с 1995 года до настоящего времени, 13-ти летний срок выживаемости среди пациентов, перенесших трансплантацию в хронической фазе, составляет - 70%, в ремиссии благодаря ИТК после бластного криза – 35 % в бластном кризе –20%.
Профессор Вивьен Оэлур также объяснила, что низкая приверженность к терапии (несоблюдение предписания врача по приему препарата) может быть обнаружена в процессе молекулярного постоянного мониторинга (Исследования по приверженности, выполненные Всемирной Сетью Защитников ХМЛ пациентов - CML Advocates Net , были приведены в данной презентации).
Альтернативные подходы к уничтожению злокачественного клона: комбинации Ингибиторов Тирозинкиназы и новые подходы. Профессор Ричард Ван Эттен (Dr. Richard Van Etten)
Доктор Ричард Ван Эттен из Бостона представил доклад по альтернативным подходам к уничтожению стволовых лейкозных клеток с помощью перспективных комбинаций ИТК и новых методов.
В своем выступлении он остановился на текущих исследованиях по прекращению терапии, отметив, что монотерапия для большинства пациентов с ХМЛ не является излечивающей. Главные вопросы по излечению: могут ли стволовые лейкозные клетки ХМЛ стать причиной рецидива и, если да, как на них можно воздействовать и какие биологические методы воздействия на эти клетки могут быть перенесены в клиническую практику излечения пациентов.
Доктор Ван Эттен объяснил подробно критические пути выживания лейкозных стволовых клеток при ХМЛ и обсудил наиболее перспективные подходы к уничтожению лейкемии. Более детально он показал 9 различных биологических механизмов, которые в настоящее время исследуются в 26 клинических испытаниях, направленных на удаление лейкозных стволовых клеток ХМЛ:
JAK2 –ингибиторы (например, Руксолитиниб); mTOR - ингибиторы, COX - ингибиторы, GSK-3бета-ингибиторы, MNK-ингибиторы, игольчатый путь/SMO-антогонисты, 5-LO ингибиторы, HSP90 ингибиторы, мышьяковые мишени / PML разрушение, ингибиторы –автофаги, (Chloriquine), пан-HDACингибиторы (например, LBH589), SIRT1 ингибиторы, Пан-BCL2ингибиторы, а также ингибиторы белкового синтеза. Многие из перечисленных ингибиторов в настоящее время проходят I|II фазы клинических исследований. Интерферон-альфа (немецкое исследование TIGER), четыре различных вакцины (СML0206), одно моноклональное антитело и другие поверхностные клеточные антигены сейчас исследуются. Пробуждение спящих стволовых клеток с помощью Иматиниба + G-CSF также тестируется более 5 лет.
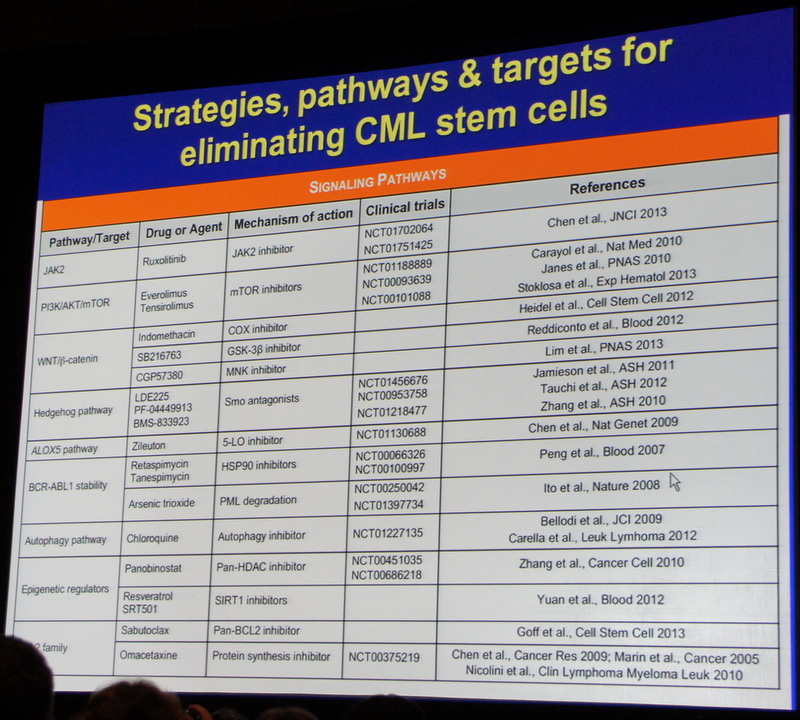
В заключении доктор Ван Эттен сказал, что в настоящее время существует много так называемых препаратов-кандидатов в обращении, но будет нелегко доказать их преимущества и отчасти потому, что требуется время и значительное количество участвующих в их испытаниях пациентов.
Набор участников клинических исследований может быть трудным, учитывая высокую эффективность и переносимость текущего лечения ингибиторами тирозинкиназы. Таким образом, любое введение или комбинация препаратов требует безопасности и хорошей переносимости, чтобы потом применяться в лечении ХМЛ.
Доклад подготовили: Джиора Шарф и Ян Гайсслер 17.12.2013
Перевод: С.П. Куликов, Вице-президент ВООГ «Содействие» по ПФО, http://sodeystvie-cml.ru/novosti/obzor-konferencii-amerikanskogo-obshhestva-gematologovash7-10-dekabrja-2013goda-ssha.html
Оригинал на английском языке: http://cmladvocates.net/3-news/newsflash/306-ash-education-session-an-embarrassment-of-riches
Обсуждение на форуме: http://osanna.com.ua/forum/viewtopic.php?p=1050#p1050